p16ファミリーに関する新発見
p16 ファミリー(INK4ファミリー)は、発癌、癌体質、診断、予防、治療の全てにわたり、重要である。
p16 ファミリーを用いた遺伝子調節化学予防、及び遺伝子調節化学療法の開発
私達は、ヒト発癌に重要である癌抑制遺伝子p16とそのファミリー遺伝子群(p15、p18、p19)に着目している。p16遺伝子は、様々な悪性腫瘍の約半数において失活している。失活の原因としては、突然変異だけでなく、喫煙によるプロモーター領域の過剰メチル化も知られている。近年、p16と同様の活性を有する類似遺伝子として、p15、p18、p19 が相次いで発見された。これらの遺伝子産物は、p16同様、サイクリン依存性キナーゼ(CDK)阻害分子として、癌抑制遺伝子RB蛋白を活性化型(脱リン酸化型)にすることにより、細胞増殖(発癌)を抑制する。これらの遺伝子は、一部の癌でのみ失活が報告されたものの、ほとんどの癌で正常に保たれていることが明らかとなった。そこで、私達は、p15、p18、p19 の遺伝子発現を薬剤により活性化することができれば、p16の機能を代償することにより、p16が失活した癌に対する新しい予防法や治療法の開発につながると考えている(後掲関連文献1, 下図参照)。
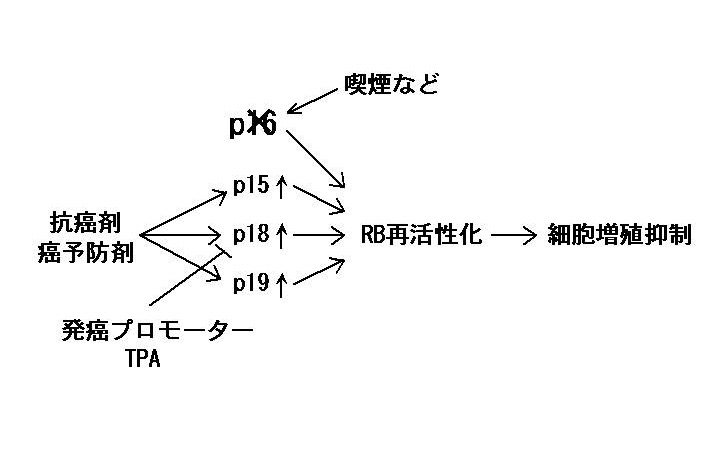
先ず、酪酸やトリコスタチンAなどのヒストン脱アセチル化酵素(HDAC)阻害剤が p15 遺伝子を活性化して、癌細胞増殖を抑制することを明らかにした(2)。酪酸は、大腸において、食物繊維が細菌発酵されることによって生じ、大腸癌の予防に寄与していると考えられている。また、HDAC 阻害剤は、副作用が少ない新しいタイプの抗癌剤や化学予防薬として現在注目を集めている。さらに、私達は、HDAC 阻害剤が p19 遺伝子も活性化することを明らかにした(3)。p15 遺伝子同様、p19 遺伝子においても私達が初めてクローニングした p19 プロモーターの Sp1 部位を介して活性化されることも明らかにした(3,4)。さらに、最近、HDAC 阻害剤が p18 遺伝子も活性化することも見いだした(5)。
癌の「遺伝子調節化学予防」と「遺伝子調節化学療法」の項で述べた如く、 p53 遺伝子が失活している癌において、 p53 の下流の p21/WAF1 を始めとする遺伝子群を活性化することにより、 p53 の機能を代償して、癌の治療・予防効果を示すことを明らかにした。それに対して、p16 遺伝子が失活している癌においても、その類似機能を持つファミリー遺伝子群を活性化して p16 の機能を代償することにより、癌の治療・予防効果を示すことを示した。この発見により、 HDAC 阻害剤が p53 だけでなく p16 が失活している癌においても有効であることが理論的に示されたので、今後のテーラーメイド治療や予防における臨床的意義は極めて大きい。
また、疫学的データから、ブロッコリー、カリフラワーなどのアブラナ科の野菜を多く摂取することが、様々な癌のリスクを軽減させることが明らかとなっている。私達は、それらの野菜に含まれているインドール-3-カービノール(I3C)という成分に着目し、I3Cがp15遺伝子を活性化して、癌細胞増殖を抑制することを明らかにした(6)。さらに、抗癌剤として期待されている15-deoxy-Δ12,14-prostaglandin J2 が p15 遺伝子を誘導することにより RB を活性化して、抗腫瘍効果を起こすことを見いだした(7)。
動物二段階発癌実験の意義に関する研究
今までの癌予防医学における最重要課題の一つとして、動物を用いた二段階発癌実験がヒト発癌を反映しうるか否かという問題があった。その点が明らかにされていなかったために、この系において発癌抑制効果を示した薬剤が、ヒトに応用できるか否かに関して議論があった。
そこで私達は、環境発癌因子であり、かつ強力な発癌プロモーターとして二段階発癌で頻用されるホルボールアセテート(TPA)がp18遺伝子の発現を抑制することにより、ヒト癌細胞の増殖を促進することを明らかにした。さらに、このTPAの作用が、プロテインキナーゼCを介するが、AP-1の活性化とは無関係であることを示した(8)。加えて興味深いことに、抗発癌プロモーター物質で、食品中に含まれる複数の成分によって、そのTPAによる作用が阻害されることが判明した。
これらのことから、動物二段階発癌モデルは少なくとも一部はヒト発癌を反映していることが明らかとなった。さらに、代表的発癌抑制物質がこの TPA による p18 抑制効果を阻害したことから、この系を用いたスクリーニング系が、よりヒト発癌抑制物質のスクリーニング系に適している可能性を示唆した。
転写因子Oct-1によるp15の遺伝子調節発現機構と細胞老化
当教室で、p15遺伝子の発現抑制にOct-1という転写因子が働いていることを明らかにした(9)。Oct-1はHDACと結合し、p15の遺伝子調節プロモーター上にHDACをリクルートすることによってその領域のヒストンが脱アセチル化され、p15の転写が抑制されると考えられる。また、細胞老化に伴って、Oct-1の発現が減少し、p15の発現が増加することも判明した。すなわち、本研究により、Oct-1によりp15の遺伝子発現が抑制されるという事実に加え、細胞老化に伴って、Oct-1が減少することによりp15の発現が増加した結果、RBが活性化型になり細胞増殖を抑制することが、細胞老化の本質の一つであるという、極めて興味深い可能性が初めて示された。
p15発現調節研究に端を発した、新規分子標的薬の同定・発見と、新規発癌抑制経路の発見
私達は、殆どの悪性腫瘍において、最終的に癌抑制遺伝子であるRBが蛋白レベルで失活することに着目し、 RB 蛋白を活性化させるCDK阻害因子(p21/WAF1、p27、p15、他)の発現を増加させる物質をいくつかの国内大手製薬会社と大規模スクリーニングを行ってきた。その結果、現在、臨床治験に近々入ることが期待される新規分子標的薬を数個見いだすことに成功した。ただし、これらの開発段階に関する詳細は産学連携研究を行っているため、現時点では公にはできないので、今までの研究経過を部分的に述べるにとどめる。
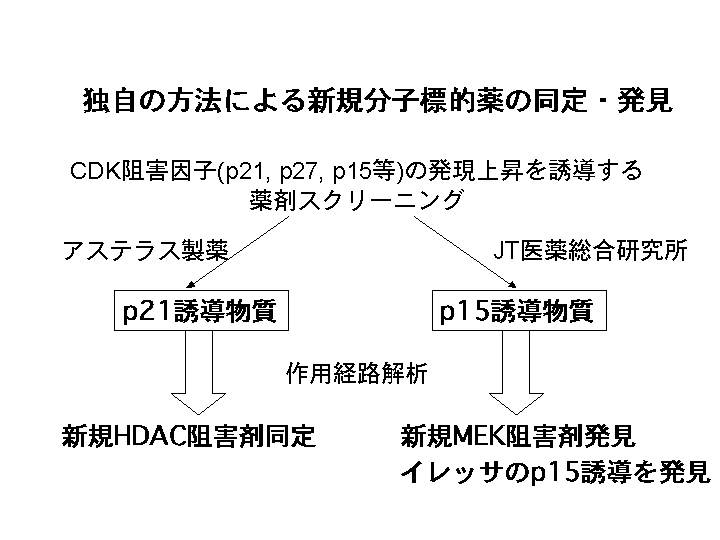
山之内製薬(現アステラス製薬)とは、p21の発現誘導物質のスクリーニングを行い、インハウスライブラリーの中から、極めて強力なヒストン脱アセチル化阻害剤を見いだした(10)。他のCDK阻害因子の活性化物質のスクリーニングを他社とも行い、来春には臨床試験に入る予定の新規分子標的薬も見いだしている。
さらに、本項目に関係した開発として、JT医薬総合研究所との共同研究により、p15遺伝子発現増強物質のスクリーニングを行い、新規MEK阻害剤を見いだすことに成功した(11)。ここで興味深いのは、従来MEK阻害剤がp15の発現を誘導するということは報告されていなかったものの、私達の仮説である、種々の本質的な分子標的薬は最終的には、CDK阻害因子の活性化などを介して RB 蛋白を活性化させるという仮説が証明されたことになる。この一連のMEK阻害剤は現在、メガファーマに導出され、順調に開発研究が行われるに至っている。
加えて、このp15誘導物質を検索する過程で、EGFR阻害に働く分子標的薬であるイレッサ(ゲフィチニブ)と構造類似性のある物質が見いだされたために、イレッサによるp15遺伝子発現増強を検討したところ、その発現を著明に増強することを見いだした(12)。このイレッサの効力はp15が存在しないと弱くなることから、癌のテーラーメイド医療にも貢献しうる可能性も示された。
(関連文献)
- Matsuzaki Y. and Sakai T. INK4 family – a promoising target for ‘gene-regulating chemoprevention’ and ‘molecular-targeting prevention’ of cancer-. EHPM, 10: 72-77, 2005.
- Hitomi, T., Matsuzaki, Y., Yokota, T., Takaoka, Y., and Sakai, T. p15INK4b in HDAC inhibitor-induced growth arrest. FEBS Letters, 554: 347-350, 2003.
- Yokota, T., Matsuzaki, Y., Miyazawa, K., Zindy, F., Roussel,
M., and Sakai, T. Histone deacetylase inhibitors activate p19INK4d gene through Sp1 site in its promoter.
Oncogene, 23: 5340-5349, 2004. - Matsuzaki, Y., Miyazawa, K., Yokota, T., Hitomi, T., Yamagishi, H., and Sakai, T. Molecular cloning and characterization of the human p19INK4d gene promoter. FEBS Letters 517: 272-276, 2002
- Yokota, T., Matsuzaki, Y., and Sakai, T. Trichostatin A activates p18INK4c gene: Differential activation and cooperation with p19INK4d gene.
FEBS Letters, 574: 171-175, 2004. - Matsuzaki, Y., Koyama, M., Hitomi, T., Kawanaka, M., and Sakai, T. Indole-3-carbinol (I3C) activates the cyclin-dependent kinase inhibitor p15INK4b gene.
FEBS Letters, 576: 137-140, 2004. - Matsuzaki, Y., Koyama, M., Hitomi, T., Takaoka, Y., Kawanaka, M., and Sakai, T. 15-deoxy-Δ12,14-prostaglandin J2 activates the expression of p15INK4b gene, a cyclin-dependent kinase inhibitor. International Journal of Oncology.
27: 497-503, 2005. - Matsuzaki, Y., Takaoka, Y., Hitomi, T., Nishino, H., and Sakai, T. Activation of protein kinase C promotes human cancer cell growth through downregulation of p18INK4c.
Oncogene, 23: 5409-5414, 2004. - Hitomi, T., Matsuzaki, Y., Yasuda, S., Kawanaka, M., Yogosawa, S., Koyama, M., Tantin, D., and Sakai, T. Oct-1 is involved in the transcriptional repression of the p15INK4b gene. FEBS Letters, 581: 1087-1092, 2007
- Shindoh, N., Mori, M., Terada, Y., Oda, K., Amino, N., Kita, A., Taniguchi, M., Sohda, K.Y., Nagai, K., Sowa, Y., Masuoka, Y., Orita, M., Sasamata, M., Matsushime, H., Furuichi, K., and Sakai, T.
YM753, a novel histone deacetylase inhibitor, exhibits antitumor activity with selective, sustained accumulation of acetylated histones in tumors in the WiDr xenograft model. International Journal of Oncology, 32: 545-55, 2008. - Yamaguchi, T., Yoshida, T., Kurachi, R., Kakegawa, J., Hori, Y., Nanayama, T., Hayakawa, K., Abe, H., Takagi, K., Matsuzaki, Y., Koyama, M., Yogosawa, S., Sowa, Y., Yamori, T., Tajima, N., and Sakai, T. Identification of JTP-70902, a p15INK4b-inductive compound, as a novel MEK1/2 inhibitor.
Cancer Science, 98: 1809-1816, 2007. - Koyama, M., Matsuzaki, Y., Yogosawa, S., Hitomi, T., Kawanaka, M., Sakai, T. ZD1839 induces p15INK4b and causes G1 arrest by inhibiting the MAPK/ERK pathway. Molecular Cancer Therapeutics, 6:1579-1587, 2007.
